作者:尤迪
近日,万象城官网awc777万象城娱乐官网和生物反应器工程国家重点实验室叶邦策教授团队在蛋白质酰基化修饰及CRISPR基因编辑效率改进领域取得新进展,相关研究成果以“Acylation driven by intracellular metabolites in host cells inhibits Cas9 activity used for genome editing”为题,发表于PNAS Nexus。PNAS Nexus是美国国家科学院旗舰期刊PNAS的兄弟期刊,创刊于今年3月,专注于发表生物、医学、物理、社会和政治科学、工程和数学等领域的高质量原创研究,编辑委员会主要来自于美国国家科学院、国家工程院和国家医学院院士。
CRISPR技术是一种为合成生物学及基因治疗的大规模发展奠定基础的使能技术,原则上实现了对基因组编辑改造或重编程的可能性。现有的研究发现在不同宿主细胞不同环境条件,CRISPR基因编辑效率差别非常大,但影响CRISPR基因编辑效率的分子机制尚未了解。解析其分子机制并精准调控宿主细胞中Cas酶的活性对于CRISPR技术的实际应用至关重要。
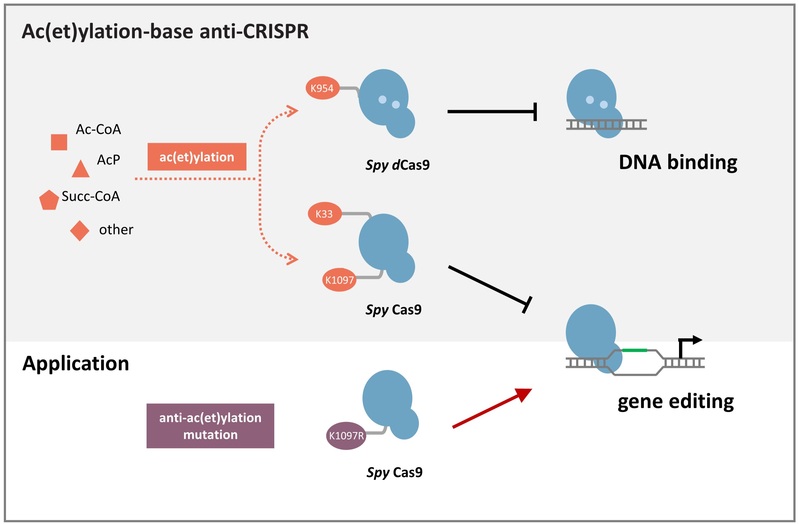
叶教授团队研究发现,外界环境或营养引起的细胞内代谢产物积累(如乙酰磷酸、乙酰辅酶A、琥珀酰辅酶A等)会造成基因编辑元件Cas9蛋白的翻译后(酰基化)修饰(如乙酰化、琥珀酰化),通过位点鉴定和体内体外实验分析证实,K954位点的乙酰化显著抑制SpyCas9蛋白(来自于Streptococcus pyogenes)与靶标DNA的结合,而K33和K1097位点的乙酰化显著抑制SpyCas9蛋白对靶标DNA的切割活性,其中,根据酰基化修饰原理对K1097位点进行突变改造,能够屏蔽酰基化修饰的抑制作用,显著增强Cas9的切割活性,有潜力开发为更加高效的基因编辑工具。此外,研究还发现,除了Cas9蛋白以外,其他Cas蛋白如Cas12a在细胞内受到酰基化修饰并且对其顺式和反式切割活性产生抑制作用,从而表明酰基化修饰对Cas蛋白活性的影响具有普适性。这种代谢波动引起的酰基化修饰会严重影响CRISPR基因编辑效率,因此,在开展CRISPR基因编辑研究中需要考虑了翻译后修饰的影响,建立基于翻译后修饰的Cas酶理性改造及实验设计优化策略。代谢产物驱动的酰基化修饰抑制Cas活性可能具有生物学意义,在细菌与噬菌体相互竞争的进化历史中,噬菌体已进化多种拮抗细菌CRISPR免疫系统的方法,如合成抗CRISPR蛋白(Acr),通过蛋白质互作或蛋白质修饰改变CRISPR-Cas活性,逃避CRISPR免疫系统;该研究成果揭示基于非酶催化的酰基化修饰可能是噬菌体进化的一种与Acr介导机制截然不同的抗CRISPR机制,噬菌体感染导致细胞内代谢变化,代谢产物积累并修饰Cas蛋白,有效逃避细菌CRISPR免疫系统。
近年来,叶邦策教授在蛋白质的翻译后修饰调控与合成生物学领域取得了一系列研究成果,发现和解析了以蛋白质酰基化为代表的翻译后修饰在压力响应、蛋白质翻译、营养代谢、次级代谢产物的合成代谢以及病原微生物的致病性等过程中的新功能和分子机制;建立了基于翻译后修饰的代谢工程策略(PTM-ME)、核糖体工程策略(PTM-RE)、以及基因组与细胞工程策略(PTM-GE/CE),可广泛应用于目标产物的高效合成、指定蛋白质的选择性表达以及高效基因编辑等合成生物学领域(Proc Natl Acad Sci USA. 2016, 113: 6653-6658; Cell Chem Biol. 2018, 25: 1-12; ACS Synth Biol. 2019, 8: 371-380; ACS Infect Dis. 2021, 7: 927-936; Commun Biol. 2022, 5: 892; Mol Microbiol. 2022, doi:10.1111/mmi.14998)。
博士生赵利和尤迪副研究员为本论文的共同第一作者,叶邦策教授、尹斌成教授和周英副教授为共同通讯作者。本研究得到了国家重点研发计划和国家自然科学基金等项目支持。
论文链接:https://doi.org/10.1093/pnasnexus/pgac277